【新唐人北京时间2021年10月12日讯】美国默克药厂(Merck)与瑞奇贝克医疗公司(Ridgeback Therapeutic)近日表示,根据最新的临床试验结果,一种抗病毒药物——莫纳皮拉韦(Molnupiravir),能够降低新冠患者的重症和死亡风险。
默克计划尽速向FDA申请莫纳皮拉韦的紧急使用授权(EUA),如经批准,将成为全球第一款抗新冠口服药物。先前用来治疗新冠患者的其它药物,比如瑞德西韦(Remdesivir),使用方式皆为静脉注射,因此不适合在感染初期广泛应用。
莫纳皮拉韦降低一半的住院、死亡风险
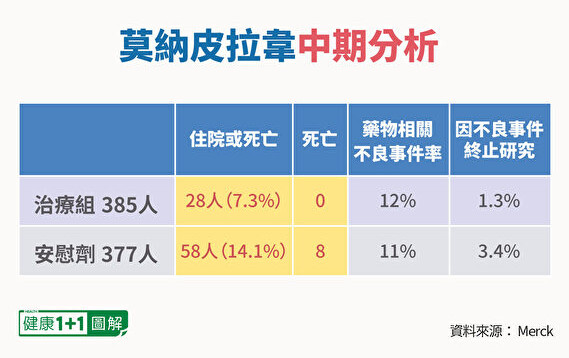
根据临床试验的中期结果分析,轻度、中度新冠肺炎患者服用莫纳皮拉韦,其住院、死亡风险能够降低约一半(50%)。
约775名新冠患者在试验中被随机分为两组,一组服用莫纳皮拉韦,另一组则使用安慰剂治疗。
在第 29 天,7.3% 接受莫纳皮拉韦治疗的患者住院,但没有人死亡,而安慰剂组则有14.1%的住院与死亡比例,其中有8人死亡。
此外,莫纳皮拉韦针对Delta变种、Gamma变种和Mu变种等变种病毒,表现出一致的疗效。
莫纳皮拉韦如何对抗病毒?
莫纳皮拉韦是一种核糖核苷类似物,它可以诱使病毒在复制过程中出错,借此降低身体中的病毒量。
在此临床试验中,患者每日服用两次含莫纳皮拉韦的胶囊,共持续5天。
莫纳皮拉韦尚未出现明显副作用
根据统计,莫纳皮拉韦组和安慰剂组的不良事件发生率,分别为 35% 和 40%,两者之间没有明显的差异。而与药物相关的不良事件发生率也差不多,分别为 12% 和 11%。
此外,与安慰剂组(3.4%)相比,莫纳皮拉韦组由于不良事件而停止接受研究治疗的受试者较少(1.3%)。
总而言之,目前莫纳皮拉韦并没有被观察到明显的副作用,但仍有待更多研究证实。

莫纳皮拉韦何时上市?
默克药厂表示,将向美国食品药品监督管理局(FDA)申请莫纳皮拉韦的紧急使用授权。
此外,默克也与世界各国签订莫纳皮拉韦的供应与采购协议,预计今年年底能够生产出足够1000万人使用的药物。
美国FDA在今年年初已下订170万份的药物,澳洲在几天前亦宣布订下30万份。
身处纷乱之世,心存健康之道,就看健康1+1!
(转自大纪元/责任编辑:李乐真)